PRISMは、タンパク質の二次構造に存在するα-ヘリックスおよびβ-ターンのペプチドを模倣する独自の創薬技術によって、細胞内および外部ドメインのタンパク質間相互作用(PPI)を制御することを可能にしました。 PRISM独自の化合物骨格は、ペプチドの骨格構造を正確に模倣し、天然または非天然のアミノ酸側鎖を付加することでペプチド模倣化合物が生成されます。
独自のPepMeticsライブラリには、様々なアミノ酸配列を模倣する20,000以上の化合物が含まれます。
PRISMは、ライブラリー化合物、および様々な骨格と置換基を組み合わせた化合物をカバーする 特許 を保有しています。
PepMetics化合物は、ペプチドと同様の機能をもちつつ、低分子のように自在由に合成できます。
自然界では、ペプチドが多くのタンパク質間相互作用(PPI)に対して選択性と親和性を持つことが示されています。一方で、科学技術を用いて、低分子を自在に合成し、経口薬を開発することも可能です。PepMetics™ 技術は、自然と科学の両方の利点を組あわせもつ、画期的な創薬基盤です。
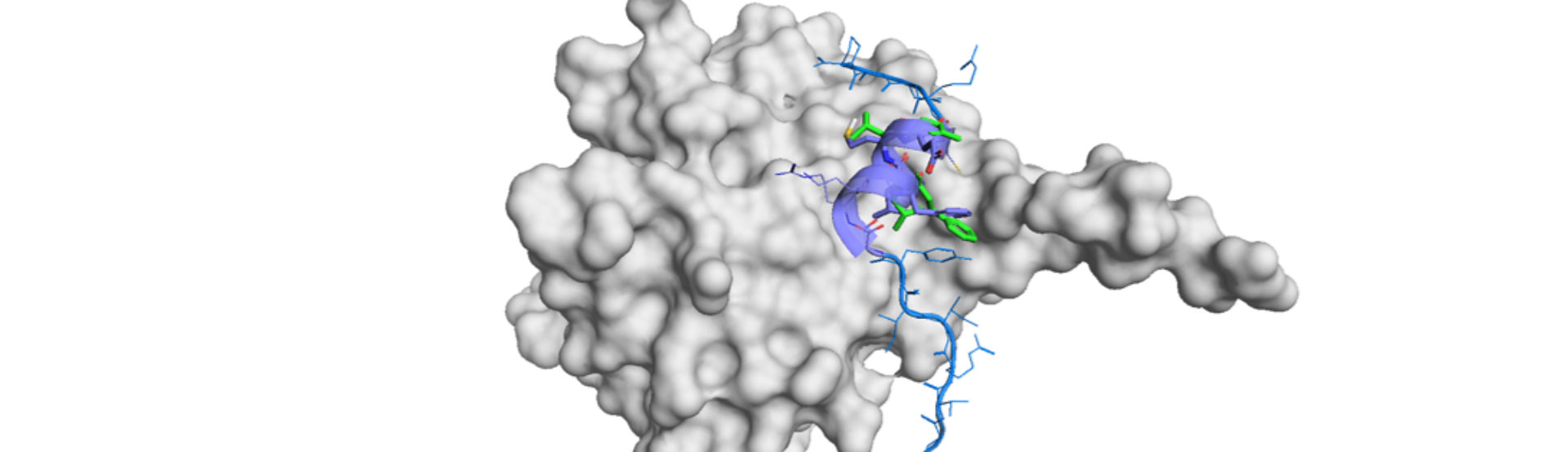
PepMetics™化合物は低分子として容易に合成できると同時に、ペプチド骨格の正確な模倣によりPPIの選択性と親和性を達成することができます。
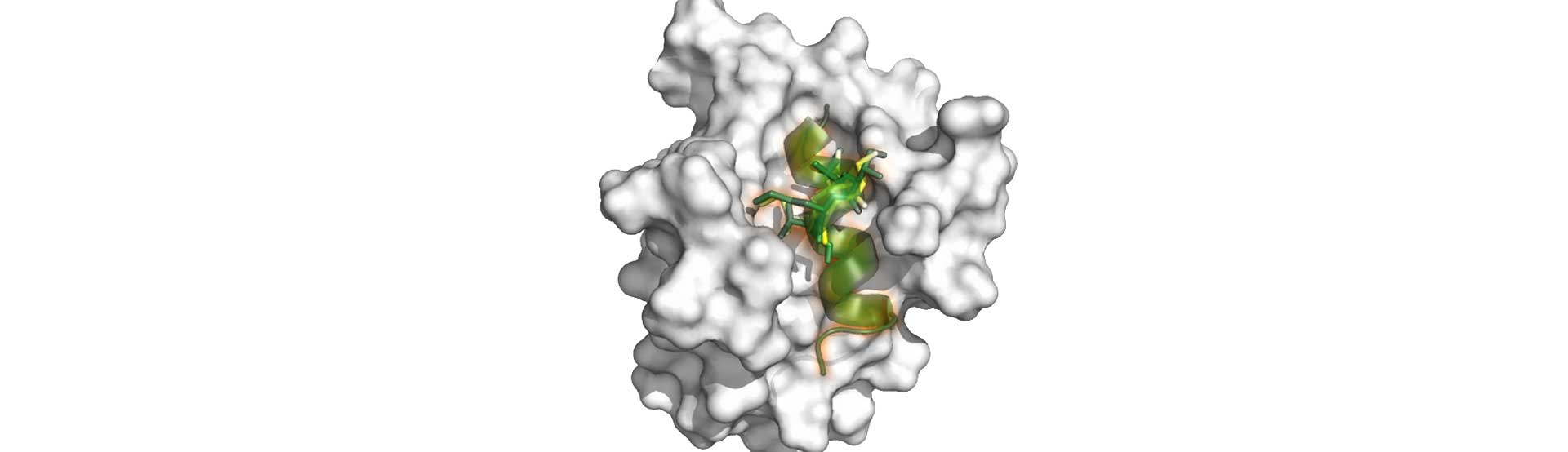
PRISMの模倣化合物は、自然界に存在するα-ヘリックスやβ-ターンの形状を取り、安定したコンフォメーションを維持します。
PepMeticsTM 化合物は、独自の技術によって短いα-ヘリックスおよびβ-ターンペプチドの二次構造を安定的に維持します。 構造が安定していることでエントロピー損失を減少させ、結合親和性を大幅に改善します。
短いα-ヘリックスおよびβ-ターンのペプチドは、その構造が不安定なために、そのままでは二次構造を保つことができません。PRISM社が独自に開発したPepMeticsTM 技術により、短くて安定したα-ヘリックスおよびβ-ターンペプチドを模倣化合物が可能になります。 独自の骨格が、天然のα-ヘリックスとβ-ターンコアを模倣し、安定した配座を実現します。
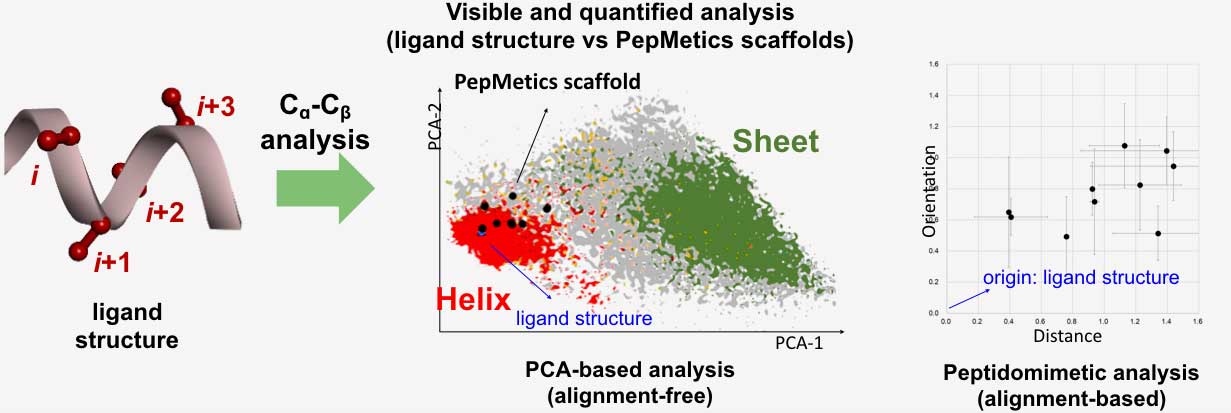
自然界では、α-ヘリックスの中でも曲がったり伸びたり捻じれたりしたさまざまな形状を取っているものがあります。自然界のさまざまなペプチドリガンド構造を模倣するには、それぞれ適した骨格を利用することが重要です。
当社は、対象とするペプチドの骨格と模倣化合物の骨格の類似度を評価するために、2種類の分析を用いた独自の方法を開発ました。
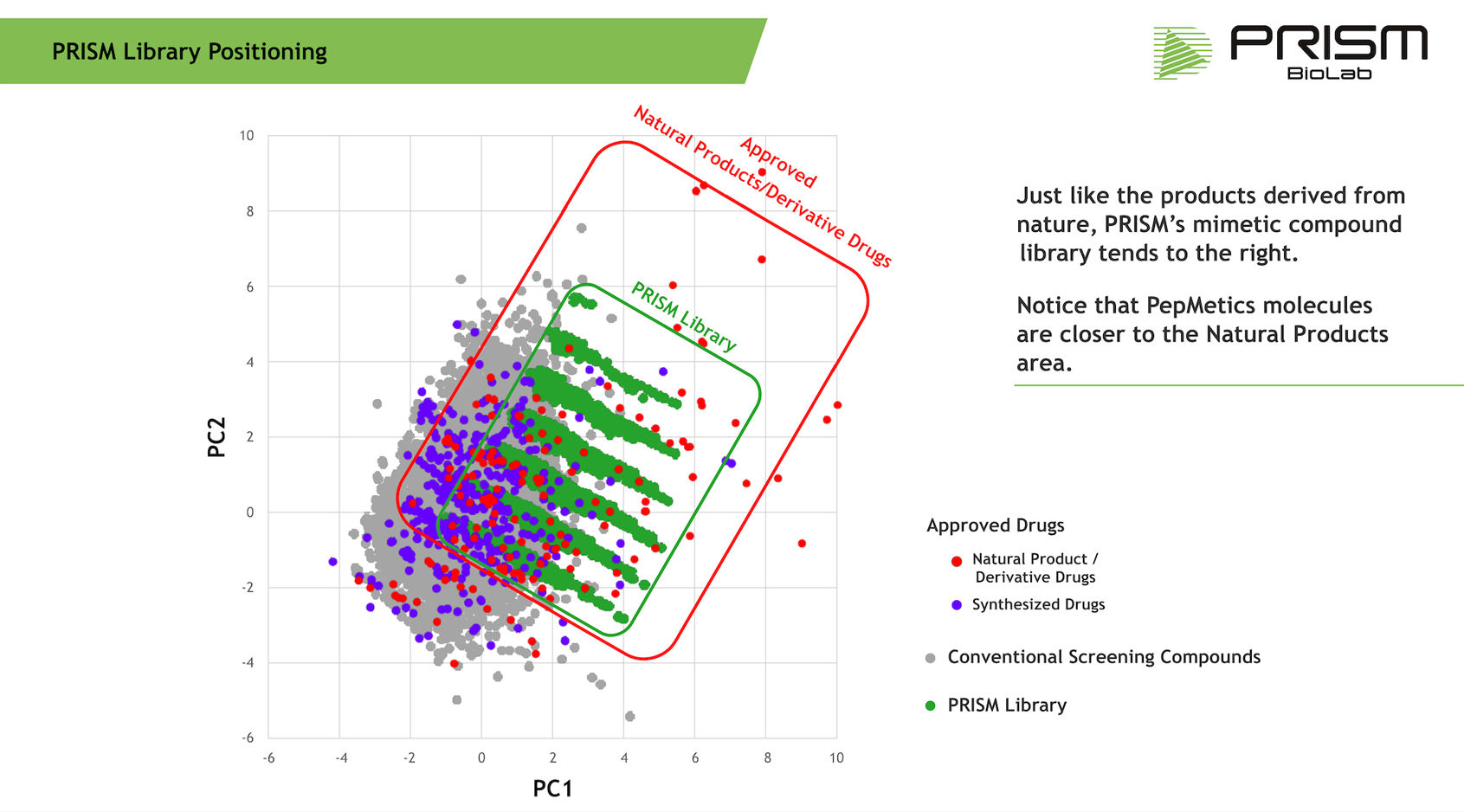
PepMetics™ 化合物は、従来のスクリーニング化合物とは異なる特徴を持っています。下の図は、ハイ・スループット・スクリーニングによく使われる従来の低分子とPepMetics™ライブラリー化合物の違いを示しています。PepMetics™化合物が天然物に近い領域にあることが分かります。
PepMetics™ Molecules can be synthesized via various combinations of elements from the PepMetics™ Library including 40 types of scaffolds and 50 types of side chain.